Enfermedad pulmonar obstructiva crónica (EPOC)
Última edición el : 22/09/2024
La enfermedad pulmonar obstructiva crónica (EPOC) se define como una limitación permanente del flujo aéreo espiratorio debida a bronquitis crónica y/o enfisema. La obstrucción bronquial suele ser progresiva e irreversible, pero puede ir acompañada de hiperreactividad bronquial y ser parcialmente reversible. Deben descartarse otras causas obstructivas (fibrosis quística, bronquiolitis obliterante, etc.). El tabaquismo es, con mucho, el principal factor etiológico.
La bronquitis crónica se define como tos y expectoración durante > 3 meses/año durante 2 años consecutivos cuando se han excluido otras causas de tos crónica. El enfisema se define como un pulmón caracterizado por un agrandamiento anormal de los espacios aéreos por encima del bronquiolo terminal, acompañado de destrucción de las paredes alveolares sin fibrosis evidente.
La prevalencia de estos síndromes se estima en un 5%, pero sólo un 15% de ellos presentan un síndrome obstructivo franco que podría conducir al diagnóstico de EPOC. La proporción entre sexos es de aproximadamente 2 hombres por 1 mujer, lo que refleja esencialmente el predominio masculino del tabaquismo. Sin embargo, dados los mismos factores de riesgo, se considera que las mujeres tienen más riesgo de desarrollar EPOC que los hombres. La prevalencia aumenta directamente con la edad y la pobreza (exposición a contaminantes y tabaquismo).
La tasa de mortalidad por EPOC ha aumentado un 71% en 20 años hasta alcanzar el 2-5% de los fallecimientos, principalmente en los países en vías de desarrollo. Esta cifra está probablemente infravalorada (los fallecimientos debidos a insuficiencia cardiaca derecha, fase final de la EPOC, se clasifican frecuentemente como causas cardiacas). Se cree que es la 3ª causa de muerte después de los accidentes cardiovasculares y el cáncer. Es la causa del 10% de los ingresos hospitalarios en medicina respiratoria.
NB: la bronquitis crónica simple en fumadores, sin síndrome obstructivo (sin disnea de esfuerzo ni anomalías en la exploración), tiene un pronóstico excelente cuando se deja de fumar.
Etiologías, factores de riesgo y factores agravantes
La bronquitis crónica está relacionada con la irritación, que provoca hiperplasia de la pared bronquial, cicatrización e hiperproducción mucosa. El enfisema está relacionado con un desequilibrio entre los factores destructivos (elastasa y otras proteasas liberadas por los neutrófilos, oxidantes) y los factores protectores (antiproteasas y antioxidantes) en el parénquima pulmonar.
Tabaco
Un factor etiológico importante (y agravante en los casos con otra etiología). Se estima que el 80-90% de las EPOC son atribuibles al tabaquismo (Riesgo Relativo = 10). El tabaquismo activo es la causa principal pero, en menor medida, también están implicados el tabaquismo pasivo y el tabaquismo materno (alteración del desarrollo pulmonar in utero) durante el embarazo.
El descenso anual del volumen espiratorio medio en un segundo (FEV1) en los fumadores es, por término medio, casi el doble que en los no fumadores. Sin embargo, sólo el 15% de los fumadores desarrollarán un síndrome obstructivo y, para el mismo nivel de tabaquismo, la disminución del FEV1 es muy variable entre individuos, lo que sugiere una susceptibilidad genética (¿papel de la deficiencia de alfa-1 antitripsina? ¿otra?) y/o potenciación por otras causas ambientales.
El cese del tabaquismo no restablece el diferencial de FEV1 ya adquirido, pero sí una pendiente descendente comparable a la de los no fumadores y, por tanto, ralentiza significativamente el empeoramiento.
Contaminación atmosférica (SO2, NO2, O3) y doméstica
Su papel está actualmente bien establecido, tanto como factor agravante (aumento de la descompensación y de la mortalidad) como etiológico.
Infecciones respiratorias
Las infecciones respiratorias influyen poco o nada en la evolución a largo plazo de la enfermedad, pero son una causa de descompensación, y por tanto de mortalidad, en los pacientes con EPOC grave. Además, a veces se considera que las infecciones crónicas (víricas, tuberculosis, pseudomonas aeruginosa, etc.) son responsables del desarrollo de la EPOC. Por último, parece que la aparición de una neumonía antes de los 2 años predice una disminución del FEV1 en la edad adulta.
Riesgos profesionales
La exposición a polvos orgánicos (algodón, madera, lino, cáñamo, cereales, etc.) o no orgánicos (polvos metálicos o de roca, carbón, cemento, granito, combustión de plásticos, etc.) o a gases (SO2, NO2, etc.) puede provocar neumonía.
Deficiencia de α-1-antitripsina (1% de los enfisemas)
La deficiencia de alfa-1 antitripsina (AAT) es un trastorno hereditario autosómico recesivo de expresión muy variable (muchos sujetos son asintomáticos). Es una enfermedad frecuente, infradiagnosticada y potencialmente letal. Debe investigarse sistemáticamente en pacientes seleccionados, incluso en presencia de otra causa (tabaquismo, etc.), debido a la posibilidad de un tratamiento sustitutivo. A modo de recordatorio, de todos los pacientes con EPOC, entre el 1 y el 3% son PIZZ y el 18% PIMZ.
A título informativo, se están estudiando otras anomalías genéticas cuyos efectos son más marginales pero acumulativos.
Hiperreactividad bronquial
La existencia de esta hiperreactividad y su hipotético papel en la génesis de la EPOC siguen siendo objeto de debate, al igual que si es primaria o adquirida (bajo la influencia del tabaco, por ejemplo).
Formas anatomoclínicas
Estas categorías siguen siendo objeto de controversia, y la mayoría de los pacientes presentan un cuadro que combina estas formas de diversas maneras.
Bronquitis crónica - lesiones de las grandes vías respiratorias - el Blue Bloater
Hay metaplasia con un aumento del número de células formadoras de moco, atrofia del cartílago e hiperplasia del músculo liso, lo que provoca un aumento del grosor de la pared bronquial y una reducción de la luz bronquial. Sin embargo, no existe una relación clara entre la extensión de las lesiones histológicas y la gravedad del síndrome obstructivo, ni entre la tos y el esputo y la disminución del FEV1.
Los pacientes suelen describirse como "blue-bloaters": cianosis, sobrepeso, dificultad respiratoria, disnea moderada, alto riesgo de sobreinfecciones.
Enfisema - lesiones parenquimatosas - el "Pink Puffer
Existen diferentes tipos de enfisema, que pueden coexistir, en función de la localización de las lesiones en el acino:
- Enfisema centrilobular: lesiones iniciales en el centro del acino dentro de un parénquima aparentemente normal. Las lesiones se extienden después al resto del acino. Predominan en la parte superior de los lóbulos superior e inferior. Ocurre casi exclusivamente en fumadores.
- Enfisema panlobular: el agrandamiento se distribuye uniformemente por todo el acino. A menudo está afectado todo el pulmón, aunque las bases son clásicamente las más afectadas, y las lesiones tienden a coalescer. Ocurre en pacientes con deficiencia de AAT, ancianos no fumadores y fumadores.
- Enfisema paraseptal: afectación preferente de las estructuras distales. Las lesiones se localizan principalmente en las proximidades de estructuras fijas (pleura, tabiques, vasos).
- Enfisema paracicatricial: lesiones en la vecindad de lesiones fibrosantes (secuelas de tuberculosis, sarcoidosis, silicosis, etc.), sin relación con la anatomía del acino.
- Lesiones bullosas: pueden encontrarse en los estadios avanzados de todos los tipos de enfisema. Se trata de zonas de dilatación del espacio aéreo de más de 1 cm resultantes de una confluencia de lesiones enfisematosas o de un efecto "colgajo" en un bronquio.
Los pacientes suelen describirse como "pink puffers": rosados, caquécticos, labios fruncidos, disnea importante, riesgo moderado de sobreinfecciones.
Pequeñas lesiones de las vías respiratorias
Este concepto se basa en la observación de que el aumento de la resistencia (infiltrado inflamatorio, calibre reducido, engrosamiento de la pared) predomina en las vías respiratorias periféricas, especialmente en las fases graves de la EPOC.
Lesiones vasculares
Encontradas en pacientes con EPOC con hipoxemia crónica: acumulación de células musculares lisas en la íntima de las pequeñas arterias, hipertrofia de la media, etc. Parece que estos cambios en la estructura vascular son la causa principal de la hipertensión pulmonar (HP) en estos pacientes y no la vasoconstricción hipóxica clásicamente incriminada.
Fisiopatología
La función pulmonar en adultos se deteriora linealmente con la edad en condiciones normales. Este deterioro, demasiado lento en sujetos normales para tener repercusiones clínicas a lo largo de su vida, se acelera en los pacientes con EPOC.
El factor clave es el cambio en las propiedades mecánicas de las vías respiratorias y los espacios aéreos. El aumento de la resistencia de las vías respiratorias, la reducción de la distensibilidad dinámica y la pérdida de retractilidad elástica pulmonar contribuyen a la hiperinsuflación pulmonar y a la limitación del flujo espiratorio. La heterogeneidad de estos cambios conduce a una distribución anormal de la ventilación y a una alteración de la función de intercambio de gases. Dos mecanismos pueden compensar la limitación del flujo espiratorio:
- Alargar el tiempo espiratorio para una frecuencia respiratoria (FR) y un volumen corriente (VC) constantes → acortar el tiempo espiratorio y aumentar la velocidad del flujo espiratorio aumentando la contracción de los músculos espiratorios.
- Ventilar en reposo con un VC elevado, ya que los flujos pulmonares aumentan en función del volumen pulmonar. Esto puede conducir a una hiperinsuflación dinámica deletérea, que se produce cuando la duración de la espiración es insuficiente para que el volumen pulmonar vuelva al volumen residual. Antes de la inspiración → la presión alveolar de fin de espiración (PEEP) es positiva → los músculos inspiratorios deben desarrollar una presión = PEEP antes de que la inspiración sea eficaz → aumento del trabajo ventilatorio y recurso a los músculos accesorios... mientras que la capacidad de los músculos para generar ventilación en reposo ya está deteriorada....
En los pacientes con EPOC, existe una respuesta ventilatoria reducida a las variaciones de la hematosis (secundaria a relaciones ventilación/perfusión desiguales, hipoventilación alveolar, alteraciones de la difusión de O2 y efecto shunt). Sin embargo, parece que la reducción de la sensibilidad de los quimiorreceptores es menos culpable que un aumento de la carga mecánica inspiratoria que limita la capacidad de generar un aumento de la presión motora. El hecho es que en la EPOC parece que la hipoxemia crónica y la hipercapnia conducen a una sustitución del control ventilatorio central por la pCO2 en el sujeto normal por un control en función de la pO2 → evitar la administración "sistemática" de oxígeno durante la descompensación y ser siempre prudente si es necesaria la oxigenoterapia en un paciente con EPOC (riesgo de deprimir el centro respiratorio → carbonarcosis).
Clínica
- Anamnesis:
- Buscar tos productiva crónica (> 3 meses/ años durante > 2 años) ++ por la mañana, disnea de esfuerzo lentamente progresiva (mal pronóstico), dolor torácico (descartar enfermedad coronaria, reflujo gastroesofágico, infección), hemoptisis (descartar neoplasia bronquial).
- Buscar la exposición a factores de riesgo (++ tabaquismo).
- Exploración física :
- Movilización de los músculos respiratorios accesorios, posiblemente hipertrofiados.
- Tiempo de espiración > 4 segundos
- Fruncimiento de los labios al final de la espiración
- Tórax en tonel, reducción de la distancia entre el cartílago tiroides y el manubrio a menos de 4 dedos
- Pigmentación nicotínica de los dedos, cianosis, hipocratismo digital
- Disminución del murmullo vesicular, estertores bronquiales roncadores, tos, sibilancias, percusión hipersónica
- Posibles signos de cardiopatía pulmonar crónica: edema de los miembros inferiores (OMI), turgencia yugular, reflujo hepato-yugular (HJR)
- Asterixis en caso de hipercapnia grave (encefalopatía metabólica)
Factores de mal pronóstico
Edad superior a 65 años, disnea grave, broncoespasmo, rápida tasa de disminución del FEV1, gran componente fijo del síndrome obstructivo, sobreinfecciones/descompensaciones frecuentes, signos de insuficiencia cardiaca derecha, gammagrafía heterogénea, desaturación nocturna, hipercapnia, tabaquismo persistente.
Las principales causas de muerte son la descompensación aguda, la embolia pulmonar, el neumotórax, la neoplasia bronquial asociada, la cardiopatía pulmonar o las patologías cardiovasculares asociadas.
Exámenes complementarios
El examen necesario y suficiente para el diagnóstico es el PFR.
- Radiografía de tórax: a veces normal, signos de distensión torácica, opacidades en carril (engrosamiento de las paredes bronquiales), signos de enfisema (hiperclartos a menudo en los lóbulos superiores, rarefacción vascular periférica, compresión hacia abajo de las escisuras, aplanamiento de las cúpulas, etc., sensibilidad del 60 al 85%).
- TC torácica: confirma el diagnóstico (sensibilidad 90%, especificidad 100%) y precisa el tipo de enfisema, buscando lesiones asociadas (¿cáncer?) y complicaciones.
- Gasometría: hipoxemia, a veces hipercapnia (signo de gravedad).
- Biología: ¿policitemia secundaria (fase tardía)?
- Pruebas de función respiratoria (PFR): síndrome obstructivo (disminución del FEV1 < 80%, del FEM y de Tiffeneau < 70%, aumento del VD y de la FRC) irreversible/ sólo ligeramente reversible +- DLCO y compliance.
- Electrocardiograma (ECG)
- Ecografía cardiaca: grado de HP, funciones derecha e izquierda.
- Fibroscopia :
- A realizar en caso de anomalía radiológica o de cambios bruscos de los síntomas (por ejemplo, hemoptisis).
- Permite tomar muestras bacteriológicas e histológicas.
- Centellografía de perfusión + ventilación: sirve de referencia para la evolución de la funcionalidad del parénquima y como base comparativa para un posible diagnóstico futuro de embolia pulmonar.
- Cateterismo cardiaco derecho: a realizar en caso de disminución de la tolerancia al ejercicio sin empeoramiento evidente de la obstrucción, cuando la ecografía cardiaca no sea concluyente, en caso de sospecha de enfermedad tromboembólica crónica asociada, en caso de cardiopatía izquierda asociada para evaluar la FEVI, preoperatoriamente.
- Pruebas otorrinolaringológicas y estomatológicas para buscar focos infecciosos en caso de exacerbaciones repetidas.
Insuficiencia respiratoria crónica y cardiopatía pulmonar crónica
Características clínicas: disnea progresiva con cianosis, signos de insuficiencia cardiaca derecha. La radiografía de tórax puede mostrar cardiomegalia y grandes arterias pulmonares. Gasometría: hipoxia-hipercapnia con acidosis respiratoria más o menos compensada.
Acute decompensation - COPD exacerbations
Existen muchas definiciones de exacerbación de la EPOC, que siguen siendo objeto de debate. La más utilizada, por su sencillez, sigue basándose en los criterios de Anthonisen.
Criterios de Anthonisen
Basados en 3 síntomas cardinales (disnea, volumen de esputo, purulencia del esputo), siguen siendo los más utilizados para definir la exacerbación y la gravedad de la EPOC:
- Exacerbación grave (tipo 1) = aumento de los 3 síntomas cardinales
- Exacerbación moderada (tipo 2) = aumento de 2 síntomas cardinales
- Exacerbación leve (tipo 3) = aumento de 1 síntoma cardinal + 1 síntoma de entre: fiebre sin otra etiología, infección de las vías respiratorias inferiores en los últimos 5 días, aumento de las sibilancias inspiratorias, aumento de la tos, aumento del 20% de la FC o RR.
Criterios GOLD
Los criterios GOLD son un intento de clarificar la definición. Sin embargo, no han demostrado ser superiores a los criterios de Anthonisen y son más difíciles de utilizar en la práctica ambulatoria.
- Exacerbación grave = exacerbación moderada + gasometría que muestra hipercapnia y acidosis
- Exacerbación moderada = exacerbación leve + 3 de los siguientes criterios: disnea VAS > 5, RR > 24/ min, FC > 95 lpm, SaO2 AA (o con O2th habitual) < 92% en reposo (o > 3% de caída respecto al valor basal conocido), PCR > 10 mg/l.
- Exacerbación leve = empeoramiento durante < 14 días de la disnea y/o tos y expectoración.
Evaluar la necesidad de tratamiento hospitalario
No existen criterios precisos, y el clínico debe basar su decisión en una combinación de factores graves: empeoramiento súbito de la disnea de reposo, signos de dificultad respiratoria, confusión, RR, FC, SaO2, comorbilidades, mala respuesta al tratamiento ambulatorio, falta de apoyo adecuado en el domicilio, etc.
Causas de descompensación y puntos generales
Buscar una causa desencadenante (infecciones respiratorias 47%, insuficiencia cardiaca 25%, arritmia 4%, infección extrarrespiratoria 3,9%, cáncer bronquial 3,3%, complicación quirúrgica 1,6%, embolia pulmonar 1,4%, neumotórax 1%, tratamiento con β-bloqueantes/ benzodiacepinas/antitusivos/diuréticos, traumatismo torácico, incumplimiento terapéutico, oxigenoterapia insuficiente/excesiva, atelectasia por tapón mucoso). Sin embargo, en más del 25% de los casos no se identificará ningún factor desencadenante.
Buscar signos de gravedad + factores desencadenantes + complicaciones:
- Clínica: insuficiencia cardiaca derecha, deterioro neuropsiquiátrico, polipnea, respiración paradójica [respiración con abdomen deprimido], movilización de los músculos respiratorios accesorios y corrientes de aire, cianosis, asterixis, hipertensión, taquicardia, inestabilidad hemodinámica. ¿Signos de embolia pulmonar (EP) o trombosis venosa profunda (TVP)?
- Gasometría: hipercapnia, hipoxemia ? PaO2 < 60mmHg resistente al tratamiento + presión arterial sistólica baja debe descartar embolia pulmonar.
- ECG + ecografía cardiaca: ¿arritmias? ¿dificultad isquémica? ¿signos de HP? ¿insuficiencia cardiaca?
- Biología: ¿síndrome inflamatorio? ¿insuficiencia orgánica? ¿pro-BNP y enzimas cardíacas? (d-dímeros)
- Medidor de flujo máximo: < 100 ml/min = ¡descompensación grave!
- Argumentos para un origen infeccioso: fiebre (++ bacteriana si persiste más de 3 días), aumento del volumen del esputo y/o purulencia. La presencia de signos ORL y la ausencia de fiebre sugieren una causa viral.
Manejo terapéutico - Tratamientos
Tratamiento de base
La clasificación histórica GOLD, tanto para el diagnóstico como para el tratamiento, se ha modificado en favor de una clasificación GOLD - ABE:
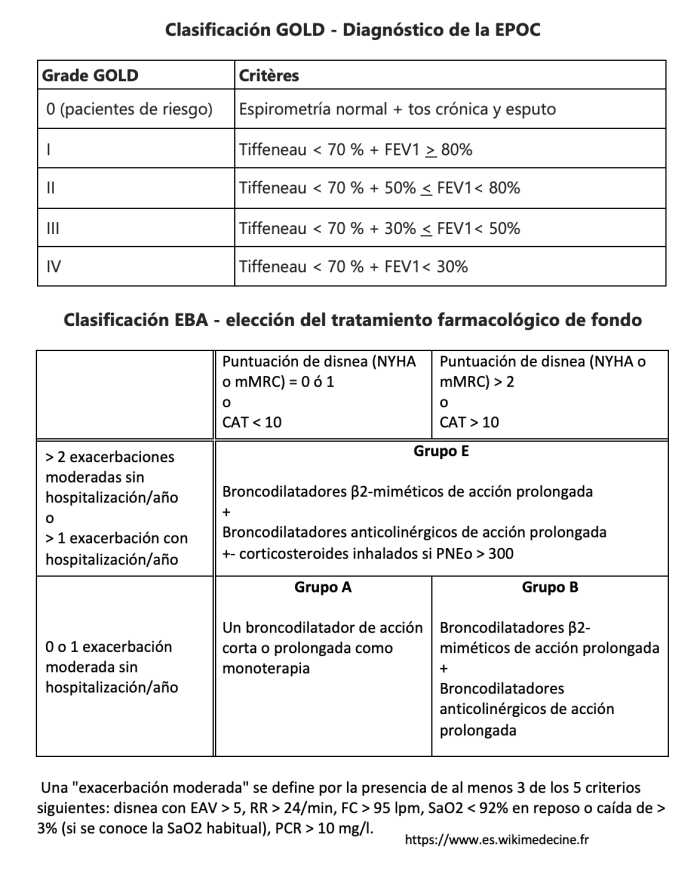
En todos los casos (incluido GOLD 0): dejar de fumar, buscar y eliminar otros factores de riesgo, reacondicionamiento físico si es posible. Debe considerarse la vacunación antigripal, antineumocócica, COVID19, tosferina y VVZ.
El tratamiento se basa en broncodilatadores: aerosoles β2-miméticos y aerosoles anticolinérgicos de acción corta o prolongada.
Los corticosteroides inhalados tienen una indicación más limitada. Deben considerarse desde el principio para los pacientes del grupo E con un NEP > 300/µL, y como intensificación del tratamiento para los pacientes del grupo E con un NEP > 100/µL que sigan teniendo exacerbaciones. El tratamiento a largo plazo con corticosteroides orales sólo debe considerarse en casos excepcionales (la relación beneficio/riesgo a largo plazo suele ser desfavorable).
La teofilina per os (xantina, de acción prolongada, 2x/día 5mg/kg, control de los niveles séricos [objetivo: 5 a 15 µg/ml]) sólo desempeña actualmente un papel marginal (toxicidad, efectos positivos limitados).
El valor del roflumilast (AINE, no disponible en Bélgica ni en Francia) o de los macrólidos como tratamiento de última línea sigue siendo objeto de debate.
Los mucolíticos y mucorreguladores no han demostrado ser eficaces.
Ya no existen dudas sobre los beneficios de la oxigenoterapia a largo plazo en pacientes con EPOC grave (cánula nasal, 1 a 2 litros/minuto, objetivo: PaO2 > 60 mmHg, > 15 h/d) con una PaO2 < 55 mmHg o una SaO2 < 88%.
La ventilación asistida a largo plazo (VNI/ventilación por traqueostomía) en pacientes gravemente inestables sólo debe utilizarse como último recurso, ya que sus beneficios aún no se han establecido. Las indicaciones quirúrgicas (resección de bullas, reducción del volumen pulmonar por enfisema difuso, trasplante pulmonar) deben ser discutidas por un equipo multidisciplinar.
Tratamiento de las descompensaciones
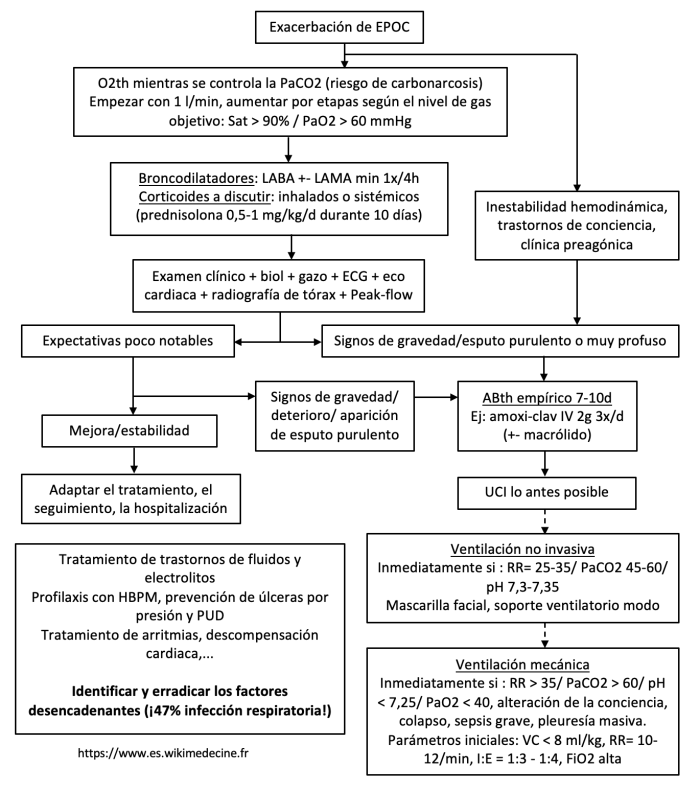
El tratamiento antibiótico empírico debe iniciarse sin duda en las siguientes situaciones:
- Exacerbación aguda con dificultad respiratoria
- Exacerbación aguda moderada a grave según Anthonisen (2 ó 3 síntomas cardinales) de EPOC moderada a muy grave (GOLD 2 a 4).
La indicación de antibióticos en otras situaciones debe discutirse sobre la base de argumentos clínicos y pruebas complementarias. Hay que tener en cuenta que las exacerbaciones víricas suelen tener un tiempo de recuperación más largo que las bacterianas. Ejemplos de regímenes empíricos:
- Sobreinfecciones bronquiales que requieren antibioterapia: augmentin/cefuroxima. Moxifloxacino si alergia a la pluma mediada por IgE o falta de respuesta al tratamiento de 1ª línea o sospecha de enterobacterias. Ciprofloxacino o ceftazidima si se sospecha Pseudomonas aeruginosa (= colonización previa, hospitalización o antibioterapia reciente, > 4 ciclos de antibióticos/año, FEV1 < 30%).
- La presencia de argumentos clínico-biológicos para un foco pulmonar requiere el tratamiento de la neumonía con comorbilidad, incluso en ausencia de un foco radiológico.
La mortalidad de los pacientes ingresados por descompensación es de ~10%. La mortalidad a los 6 meses varía entre el 21% y el 36% en caso de recidiva en los 6 meses (¡lo que concierne al 50% de los pacientes → importancia del seguimiento para evitar la rehospitalización!!!)... y en caso de recurso a la ventilación mecánica, la mortalidad se eleva al 43%.
Cualquier exacerbación que requiera hospitalización debe ser evaluada por un neumólogo unas 6 semanas después del alta (¿resolución? ¿deterioro de la capacidad respiratoria? ¿necesidad de aumentar el tratamiento de fondo?).
Prevención secundaria y modificación del pronóstico
Además del tratamiento sintomático básico y la prevención de episodios de sobreinfección, es de gran importancia convencer a los pacientes con EPOC que presentan tos crónica y/o expectoración o enfisema de que dejen de exponerse lo antes posible a los factores que contribuyen a su enfermedad (principalmente el tabaco). Por lo general, la interrupción de esta exposición conllevará una escasa mejoría clínica (componente de hiperreactividad), pero es el primer paso para mejorar el pronóstico a largo plazo del paciente. Si se interrumpe la exposición, la función respiratoria del paciente volverá a una curva de deterioro similar a la de un sujeto normal. Cuanto antes se interrumpa la exposición, mayor será la ganancia en supervivencia (hasta una morbimortalidad casi normal para los pacientes con GOLD 0).
La identificación de los pacientes con déficit de α-1-antitripsina y su tratamiento específico también son de gran importancia para detener la progresión de la enfermedad.
Bibliografía
GOLD, At a glance outpatient management reference for chronic obstructive pulmonary disease (CPOD), 2015
GOLD, Global strategy for the diagnosis, management and prevention of COPD 2023
Agusti A et al., GOLD 2023 : Highlights for primary care, npj Primary Care Respiratory Medicine, 2023
Cooper B et al, Remote Patient Monitoring for the Detection of COPD Exacerbations, Int J Chron Obstruct Pulmon Dis
Sørheim IC et al, Gender differences in COPD: are women more susceptible to smoking effects than men ?, BMJ, 2009